L'OBESITE ET L'ASTHME : UN NOUVEAU PHÉNOTYPE ? - Corpus UL
←
→
Transcription du contenu de la page
Si votre navigateur ne rend pas la page correctement, lisez s'il vous plaît le contenu de la page ci-dessous
ANDREA LESSARD
L'OBESITE ET L'ASTHME :
UN NOUVEAU PHÉNOTYPE ?
Mémoire présenté
à la Faculté des études supérieures de l'Université Laval
dans le cadre du programme de maîtrise en epidemiologic (recherche clinique)
pour l'obtention du grade de Maître es sciences (M.Se.)
FACULTE DE MEDECINE
UNIVERSITÉ LAVAL
QUÉBEC
2010
©Andréa Lessard, 2010Résumé L"obésité prédispose à plusieurs problèmes de santé dont l'asthme fait maintenant partie. Dans le premier chapitre de ce mémoire, l'obésité et l'asthme seront successivement définis. Les études portant sur l'incidence de l'asthme en présence d'obésité seront détaillées. Les caractéristiques de l'asthme chez la personne obèse seront ensuite revues. Enfin, les mécanismes physiopathologiques par lesquels l'obésité pourrait mener à l'asthme seront énumérés, en insistant sur le rôle de la leptine et de l'adiponectine. Le deuxième chapitre fera état d'une étude effectuée chez 88 sujets asthmatiques obèses et non-obèses visant à déterminer si les sujets obèses présentent un phénotype d'asthme différent. Le troisième chapitre présentera une étude portant sur le rôle de la leptine et de l'adiponectine dans l'asthme chez la personne obèse. Il apportera des données nouvelles concernant la présence de leptine au niveau des voies respiratoires. Quelques éléments de prise en charge de l'asthmatique obèse seront amenés dans la conclusion.
11 Abstract Obesity has been associated with an increased prevalence of asthma. The first chapter will define obesity and asthma. The association between obesity and asthma will be reviewed. Asthma characteristics in presence of obesity will be listed. The mechanisms by which obesity may lead to asthma will be reviewed, particularly in regard to the role of leptin and adiponectin. The second chapter will present a study on 88 asthmatic subjects, obese and non-obese. The objective of the study was to determine if obese subjects present a different phénotype of asthma. The third chapter will present a study on the role of leptin and adiponectin in asthma among obese subjects. It will bring new data in regard to the presence of leptin in the airways. Some key elements for the management of asthma in obese patients will be mentionned in the conclusion.
Remerciements Quand j'ai entrepris mon doctorat en médecine à l'automne 2004, loin de moi était l'idée d'entreprendre simultanément une maîtrise en epidemiologic Un stage d'été en recherche est venu tout changer : l'espoir de résultats révolutionnaires, le partage scientifique dans les congrès, le travail avec une équipe extraordinaire... Un merci tout spécial à Marie-Ève Boulay et Philippe Prince pour leur grande disponibilité et leur patience, à Hélène Turcotte pour m'avoir tout appris et m'avoir accompagnée dans chacun de mes projets, à Julie St- Laurent pour tous les dosages et sa grande patience dans ses explications, aux infirmières de recherche pour m'avoir toujours dit oui quand venait le temps de prélever un échantillon sanguin et surtout au Dr Louis-Philippe Boulet, mon directeur de recherche, pour m'avoir accueillie dans son équipe et laissée une grande liberté. Marie-Hélène, Julie, Marie-Claire, Valérie et Marie-Eve, merci pour tous les bons moments passés. Un merci également à l'Université Laval et aux Instituts de recherche en santé du Canada pour les bourses qui m'ont été octroyées. Maman et papa, merci d'avoir toujours cru en moi et d'avoir compris que j'aimais me tenir occupée. Vous m'avez appris à toujours aller au bout de ce que j'entreprends et m'en avez donné l'exemple. Papa, merci de m'avoir appris à raisonner et à être débrouillarde. Maman, merci de m'avoir inculqué la capacité à rester calme, à remettre les choses en perspective et à entreprendre plusieurs choses à la fois avec le sourire, sans se sentir débordée. Surtout ne sous-estimez pas l'impact que vous avez eu dans ma vie ; c'est en majeure partie grâce à vous que je suis rendue là. Grande sœur, merci d'avoir toujours su me ramener les pieds sur terre. Même si on ne se voit pas souvent, ton opinion compte beaucoup. Finalement, un merci tout spécial à Patrice pour sa présence rassurante, ses conseils, son écoute, sa disponibilité, sa patience et sa grande compréhension. Tous les moments passés avec toi sont un cadeau et je suis persuadée que nos plus belles années restent à venir. Je t'aime.
IV
Avant-propos
Ce mémoire traite de l'impact de l'obésité sur le développement et la présentation de
l'asthme. La liste suivante contient les articles issus des travaux menés à notre laboratoire
et auxquels j'ai eu le plaisir de participer. Les articles précédés d'un astérisque seront
présentés aux chapitres II et III du présent mémoire :
* Lessard A, Turcotte H, Boulet LP, Cormier Y. Obesity and asthma : a specific
phénotype? Chest 2008; 134(2):317-2
Prix remportés :
• Premier prix d'excellence de la faculté de médecine, Université Laval, 2005
• Internai Médecine Award, University of Texas Medical Branch, 2006
• Premier prix de présentation de projet de maîtrise, Association des pneumologues
du Québec 2006
Lessard A, Maltais F, Boulet LP. Clinical Management of chronic obstructive pulmonary
disease and asthma in obese patient. Expert Opin Pharmacother. 2008; 9(1 ):83-93
Boulet LP, Lessard A. Le rôle de l'obésité dans le développement de l'asthme : Évaluation
et traitement de l'asthmatique obèse. Le Clinicien 2007; 22(11): 83-88
* Lessard A, St-Laurent J, Turcotte H, Boulet LP. Leptin and Adiponectin in Obese and
Non-Obese Subjects with Asthma, (soumis à Obesity Research)
Lessard A, Aimeras N, Tremblay A, Despres JP, Boulet LP. Adiposity and pulmonary
function: relationships with body fat distribution and systemic inflammation, (soumis à Am
J Respir Crit Care Med)
Les résultats présentés dans le cadre de ce mémoire reflètent l'entière participation de
l'aspirante au grade de maître es sciences dans l'élaboration du protocole, le recrutement
des patients, la récolte des données, l'analyse de celles-ci et la rédaction des articles.
Hélène Turcotte a participé au recrutement des patients et la récolte des données. Julie St-
Laurent m'a permis de m'initier à la recherche fondamentale en contribuant à l'élaborationet la réalisation du protocole à la base du deuxième article de ce mémoire. Serge Simard et le département de statistique de l'Université Laval ont participé à l'analyse statistique. Dr Louis-Philippe Boulet a contribué à l'analyse des résultats et à l'encadrement de l'ensemble du cheminement ayant mené à la publication des données.
Table des matières
Résumé i
Abstract ii
Remerciements iii
Avant-propos iv
Table des matières vii
Liste des tableaux viii
Liste des figures ix
CHAPITRE I - INTRODUCTION 1
1. L'obésité 2
1.1 Définition 2
1.2 Prévalence 4
2. L'asthme 4
2.1 Définition 4
2.2 Méthodes diagnostiques 4
2.3 Prévalence 5
3. L'association entre l'obésité et l'asthme 5
4. Les particularités de l'asthme chez la personne obèse 7
4.1 Le changement de poids 8
4.2 La sévérité de l'asthme 8
4.3 La maîtrise de l'asthme 10
4.4 La réponse à la médication 11
4.5 L'inflammation des voies respiratoires 12
5. Influence de l'obésité sur le développement de l'asthme ; mécanismes possibles 15
5.1 Fonction respiratoire 16
5.2 Inflammation systémique 17
CHAPITRE II - L'OBÉSITÉ ET L'ASTHME :
UN PHÉNOTYPE SPÉCIFIQUE ? 21
CHAPITRE III - LEPTIN AND ADIPONECTIN IN OBESE AND NON-
OBESE SUBJECTS WITH ASTHMA 46
CONCLUSION 58
Références 61Liste des tableaux
CHAPITRE I
Tableau 1 : Classification de l'obésité selon l'indice de masse corporelle chez l'adulte
Tableau 2 : Le tour de taille comme facteur de risque selon l'ethnie et le sexe.
Tableau 3 : Sévérité de l'asthme selon les critères de l'Initiative Globale pour l'Asthme
(GINA guidelines)
Tableau 4: Résumé des agents thérapeutiques utilisés pour maîtriser l'asthme
CHAPITRE II
Table 1: Subjects' demographics and medical characteristics
Table 2: Spirometry, lung volumes and methacholine test results
Table 3: Differential cell count in induced sputum
CHAPITRE III
Table 1: Subjects' characteristicsListe des figures
CHAPITRE I
Figure 1 : Inflammation bronchique et asthme
Figure 2 : Mécanismes possiblement impliqués dans la relation entre l'asthme et l'obésité
Figure 3 : Principales adipokines augmentées dans le sérum en présence d'obésité
CHAPITRE II
Figure 1. Spearman's correlations between lung volumes, BMI, waist-to-hip ratio and
waist circumference
Figure 2. Pulmonary function results between obese and non-obese subjects
Figure 3. Differential cell count in induced sputum between obese and non-obese subjectsCHAPITRE I INTRODUCTION
1. L'obésité
1.1 Définition
L'obésité est une maladie caractérisée par un excès de tissu adipeux en quantité suffisante
pour engendrer un risque pour la santé. Elle résulte d'une balance énergétique positive dont
les causes sont multiples (1). L'obésité est un facteur de risque bien établi pour plusieurs
pathologies auxquelles l'asthme s'ajoute maintenant (2). Selon l'origine du surpoids, sa
distribution corporelle et sa composition, l'obésité comprend une vaste gamme de
phénotypes dont les effets sur la santé semblent différer. La façon de catégoriser l'obésité
revêt donc son importance.
Indice de masse corporelle (IMC)
Actuellement, le principal indicateur utilisé pour définir l'obésité est l'IMC. Ce dernier est
obtenu en divisant la masse en kilogramme (kg) par la taille en mètre au carré (m2). Selon
l'Organisation Mondiale de la Santé (OMS), l'obésité est définie par un IMC supérieur ou
égal à 30,0 kg/m2 et l'embonpoint par un IMC entre 25 et 29,9 kg/m2(3).
Tableau 1 : Classification de l'obésité selon l'indice de masse corporelle chez l'adulte
CLASSIFICATION IMC RISQUE DE CO-
MORBIDITÉS
Sous le poids santé 40 Extrêmement élevé
Tableau adapté du rapport de l'OMS (3)
Bien que le calcul de l'IMC soit une façon simple et utile d'établir le niveau d'obésité, ce
dernier comporte certaines limites. En plus de ne pas faire la différence entre la masse
musculaire et graisseuse, l'IMC ne tient pas compte de la distribution de la masse
corporelle, un paramètre très important dans l'estimation du risque pour la santé. En effet,
l'accumulation de tissu adipeux au niveau abdominal est associée à un risque accru de
maladies coronariennes et de diabète de type 2. indépendamment de la quantité totale detissu adipeux (4). Il s'agit donc d'un paramètre important à déterminer lors de l'évaluation
de la personne obèse.
Tour de taille (TT)
La mesure du TT corrèle avec la distribution du tissu adipeux au niveau abdominal et
constitue un outil intéressant pour estimer le risque pour la santé (5;6). Selon les lignes
directrices sur l'obésité de l'Association Médicale Canadienne, un TT plus grand que 102
cm chez l'homme et 88 cm chez la femme constitue un risque accru pour la santé chez les
Nord-Américains (1). Il est à noter que dans un contexte épidémiologique, un TT plus
grand ou égal à 94 cm chez l'homme et à 80 cm chez la femme est considéré comme un
facteur de risque (1).
Tableau 2 : Le tour de taille comme facteur de risque selon l'ethnie et le sexe.
GROUPE TOUR DE TAILLE (CM)
ETHNIQUE HOMMES FEMMES
Européens/Caucasiens >94 >80
Sud-Asiatiques/Chinois >90 >80
Japonais >85 >90
Amériques du Sud et Utiliser le tour de taille des Sud-Asiatiques *
Centrale
Africain/Moyen-Orient Utiliser le tour de taille des Européens *
Tableau adapté des lignes directrices de l'Association Médicale Canadienne (1)
* En attente de données plus spécifiques pour ces populations
Ratio taille/hanches (RTH)
LE RTH constitue un autre marqueur de la distribution de la masse corporelle. Un RTH
plus grand que 1 chez l'homme et que 0.85 chez la femme indique la présence d'un excès
de tissu adipeux au niveau abdominal (7). L'utilisation de ce marqueur est toutefois plus
fréquent en recherche qu'en clinique, le TT seul étant plus facile à mesurer et corrélant
davantage avec le risque pour la santé (3).1.2 Prévalence Au cours des dernières décennies, la prévalence de gens souffrant d'embonpoint et d'obésité a augmenté de façon considérable mondialement, au point où l'OMS désigne maintenant cette condition de véritable épidémie (3). Le Canada n'est pas épargné par cette problématique: entre 1978-79 et 2004, la prévalence d'adultes souffrant d'obésité a presque doublée, passant de 13,8% à 23,1%. En ajoutant les gens souffrant d'embonpoint, près de 60 % de la population canadienne présente un surpoids (http://www.statcan.ca/francais/research/82-620-MIF/2005001/articles/adults/aobesitv_f.htm. dernière consultation le 22 juin 2009). 2. L'asthme 2.1 Définition L'asthme est une affection caractérisée par des symptômes paroxystiques ou persistants tels la dyspnée, l'oppression thoracique, une respiration sifflante, une production de mucus et de la toux, associés à une obstruction bronchique variable et à une hypersensibilité des voies aériennes à divers stimuli (8;9). Tout comme l'obésité, l'asthme comprend de multiples etiologies dont une prédisposition génétique et l'exposition à des sensibilisateurs occupationnels (8;9). L'inflammation et son impact sur la structure des voies aériennes semblent les principaux mécanismes provoquant l'apparition et la persistance de l'asthme (8;9). Le diagnostic d'asthme est porté à partir de l'histoire clinique et pourra être confirmé par différents examens paracliniques décrits ci-bas (8;9). 2.2 M é t h o d e s diagnostiques Test de réversibilité bronchique La spirométrie permet de mesurer la limitation du débit respiratoire et sa réversibilité après l'inhalation d'un bronchodilatateur à courte durée d'action ( 10; 11). Un changement > 12 % (ou > 200 ml) du volume expiratoire maximal en 1 seconde (VEMS) après la prise d'un bronchodilatateur supporte un diagnostic d'asthme. Ce test manque toutefois de sensibilité, tous les patients asthmatiques, et particulièrement ceux sous traitement, ne présentant pas une telle réversibilité.
Test de provocation à la métacholine Une autre méthode utilisée pour la confirmation du diagnostic d'asthme est la mesure de la réactivité bronchique à la métacholine, une substance induisant un bronchospasme à une concentration plus ou moins élevée selon le niveau de sensibilité de l'individu (12). Les résultats du test sont exprimés comme la concentration de métacholine nécessaire pour provoquer une chute de 20% du VEMS (CP20). Une personne est généralement considérée asthmatique lorsque sa CP20 est < 4 mg/ml en présence de symptômes d'asthme, quoiqu'une zone grise existe entre 4 et 16 mg/ml. Bien que ce test soit sensible, sa spécificité est toutefois limitée, tous les patients avec un test positif n'ayant pas nécessairement de l'asthme (13). Test d'expectoration induite Bien que peu utile pour le diagnostic, la mesure de l'inflammation bronchique peut aider à déterminer le traitement optimal de la maladie (14). Le test d'expectoration induite est un test non-invasif reproductible et valide utilisé pour faire le décompte des principales cellules inflammatoires au niveau des voies respiratoires (15). Typiquement, l'asthme est associé avec une prédominance de cellules éosinophiliques et de lymphocytes Th2 produisant diverses cytokines inflammatoires (16). D'autres phénotypes inflammatoires existent cependant. 2.3 Prévalence L'asthme est l'une des maladies chroniques les plus fréquentes, touchant environ 300 millions de personnes dans le monde (17). En 2004, 14,1% des Canadiens et 10,9% des Américains d'âge adulte présentaient des symptômes d'asthme (17). Avec l'accroissement de l'industrialisation et de l'urbanisation à l'échelle mondiale, il est estimé qu'environ 100 millions de personnes supplémentaires souffriront d'asthme d'ici 2025 (17). 3. L'association entre l'obésité et l'asthme Depuis le début de l'intérêt pour la relation entre l'obésité et l'asthme vers la fin des années 1990, plus de 30 études transversales et 13 études prospectives ont été publiées. Il est
possible de consulter à ce sujet une revue de littérature assez exhaustive publiée par Ford en 2005 (18). À l'exception de trois d'entre-elles (19-21), toutes les études transversales rapportèrent une augmentation de la prévalence de l'asthme chez la personne obèse ou souffrant d'embonpoint, autant chez les adultes que chez les enfants (18). Ce n'est toutefois qu'avec la première étude prospective sur le sujet, publiée en 1999 par Camargo et collaborateurs, qu'il fut possible d'affirmer que l'obésité précédait l'asthme (22). Toutes les études prospectives suivantes, à l'exception d'une (23), indiquèrent une plus grande incidence d'asthme chez la personne obèse ou souffrant d'embonpoint (18). Les études présentaient toutefois des résultats hétérogènes. Par exemple, le risque de développer de l'asthme chez la personne obèse comparativement à la personne de poids santé variait de 1,0 à 3,5 selon les études. Alors que certaines études rapportaient une relation entre l'obésité et l'asthme similaire pour les hommes et les femmes (24;25), d'autres soutenaient une relation plus faible ou même une absence de relation chez l'homme (26-28). En 2007, Beuther et Sutherland publièrent une méta-analyse regroupant 7 études prospectives (n=333 102 sujets) et visant à obtenir un estimé précis de l'impact de l'embonpoint et de l'obésité sur le risque annuel de développer de l'asthme chez l'adulte (2). Comparativement aux sujets de poids santé, les sujets obèses ou souffrant d'embonpoint présentaient un risque de 1,51 [IC95% 1,27-1,80] de développer de l'asthme. Un effet dose-réponse fut aussi observé : comparé aux sujets de poids santé, le risque de développer de l'asthme chez les sujets souffrants d'embonpoint étaient de 1,38 [IC95% 1,17-1,62] alors que celui des sujets obèses étaient de 1,92 [IC95% 1,43-2,59] (p
tient pas compte de la distribution du tissu adipeux. Finalement, il a été suggéré que l'asthme pourrait être sur-diagnostiqué chez la personne obèse, la diminution des volumes pulmonaires, la moins bonne forme physique et les co-morbidités associés à l'obésité pouvant occasionner des symptômes similaires à ceux de l'asthme et être mal interprétés par le patient et/ou le clinicien (29). Ce phénomène aurait pour effet de surestimer le diagnostic d'asthme chez les personnes obèses, remettant en doute l'association entre l'obésité et l'augmentation de l'incidence d'asthme. Toutefois, une étude récente démontra que, bien que près du tiers des sujets avec un asthme diagnostiqué par un médecin étaient non-asthmatiques après une investigation objective, le sur-diagnostic d'asthme n'était pas plus fréquent chez les sujets obèses (31,8 % [IC95% 26,3-37,9%]) que chez les non-obèses (28,7% [IC95% 23,5-34,6%]) (30) . En somme, l'incidence de l'asthme chez la personne obèse ou souffrant d'embonpoint semble augmenter d'environ 50 % par rapport à la personne de poids santé, et ce de façon similaire chez l'homme et la femme (2). L'obésité précède l'asthme et un effet dose- réponse entre le niveau d'embonpoint et l'incidence de l'asthme a été démontré (2). Il a été suggéré que l'asthme chez la personne obèse puisse revêtir un caractère différent de l'asthme classique tel qu'on le connaît. La prochaine section présente les particularités de l'asthme chez la personne obèse. Ces particularités ont mené à la question de recherche du premier article de ce mémoire : l'obésité est-elle associée à un phénotype différent d'asthme ? 4. Les particularités de l'asthme chez la personne obèse Dans la présente section, les caractéristiques distinctives de l'asthme chez la personne obèse seront énumérées. L'impact du changement de poids sur la condition asthmatique sera d'abord abordé. La façon par laquelle l'obésité pourrait influencer la sévérité de l'asthme, son contrôle, la réponse à la médication et l'inflammation des voies respiratoires des patients asthmatiques sera ensuite traitée.
4.1 Le changement de poids Autant la prise que la perte de poids semblent influencer l'asthme. En 1999, Camargo et collaborateurs ont démontré que les sujets ayant gagné plus de 25 kg depuis l'âge de 18 ans présentaient un risque relatif de développer de l'asthme de 4,7 [IC95% 3,1-7,0] en comparaison avec ceux ayant conservé un poids stable (31). Inversement, la perte de poids semble également contribuer à l'amélioration clinique des patients souffrant d'asthme, qu'elle soit secondaire à un programme de perte de poids (32) ou à une chirurgie bariatrique (33). La revue de littérature d'Eneli et collaborateurs résume bien les différentes études sur le sujet (34). De façon intéressante, l'amélioration de l'asthme avec la perte de poids semble réversible. En effet, dans l'étude de Macgregor et Greenberg, 40 obèses morbides asthmatiques ont été soumis à une chirurgie bariatrique (35). Deux ans plus tard, 90 % d'entre eux présentaient une amélioration de leurs symptômes d'asthme. Parmi les sujets, 5 regagnèrent du poids lors du suivi. La fréquence de leur attaque d'asthme augmenta et diminua à nouveau lors de la révision de leur chirurgie. Même si la qualité méthodologique de plusieurs des études sur le sujet est limitée, le fait que leur conclusion aille dans le même sens est rassurant et procure une évidence supplémentaire pour supporter un lien causal entre l'obésité et l'asthme (34). Malheureusement, la majorité des études avait pour issu la médication utilisée pour traiter l'asthme ou un changement dans les symptômes rapportés de la maladie plutôt que des mesures objectives telles la réversibilité bronchique, le test à la métacholine ou le dosage des marqueurs inflammatoires bronchiques. L'obésité pourrait donc être associée avec une perception accrue des symptômes d'asthme qui s'améliore lors de la perte de poids, sans réelle amélioration de la condition asthmatique. 4.2 La sévérité de l'asthme On définit la sévérité de l'asthme selon le niveau de symptômes, la limitation du débit expiratoire et la variabilité de la fonction pulmonaire.
Tableau 3 : Sévérité de l'asthme selon les critères de V Initiative Globale pour l'Asthme
(GINA guidelines)
CLASSIFICATION DE LA SEVERITE DE L'ASTHME EN FONCTION DES
CARACTÉRISTIQUES CLINIQUES AVANT TRAITEMENT
INTERMITTENT LEGER
- Symptômes < 1 x/semaine - Symptômes < lx/jour
- Exacerbations courtes - Exacerbations affectent activités
- Symptômes nocturnes < 2x/mois - Symptômes nocturnes > 2x/mois
- VEMS ou débit pointe > 80 % prédite - VEMS ou débit pointe > 80 % prédite
- A VEMS ou débit pointe < 20% - A VEMS ou débit pointe < 20-30%
MODERE SEVERE
- Symptômes quotidiens - Symptômes quotidiens
- Exacerbations affectent activités - Exacerbations fréquentes
- Symptômes nocturnes > 1 x/semaine - Symptômes nocturnes fréquents
- Utilisation quotidienne P2-agoniste - Limitation des activités quotidiennes
- VEMS ou débit pointe 60-80 % prédite - VEMS ou débit pointe < 60 % prédite
- A VEMS ou débit pointe > 30% - A VEMS ou débit pointe > 30%
Tableau traduit et adapté des lignes directrices de l'Initiative Globale pour l'Asthme (8)
En plus d'être un facteur de risque pour l'asthme, l'obésité pourrait également avoir un rôle
à jouer dans la sévérité de la maladie. Une revue de littérature écrite par Shore et Johnson
résume bien les différentes études sur le sujet (36). L'hétérogénéité des méthodes utilisées
pour définir la sévérité de l'asthme et l'absence de mesure objective dans la majorité des
études limitent toutefois l'interprétation des résultats. L'absence d'association entre
l'obésité et la sévérité de l'asthme dans certaines études sème également la controverse. Par
exemple, parmi 382 sujets asthmatiques dont 149 souffrant d'embonpoint et 94 sujets
obèses, Lavoie et collaborateurs trouvèrent une tendance positive entre la sévérité de
l'asthme et l'IMC (F=3,60, p=0,06) qui s'avéra non-significative après ajustement pour le
sexe, l'âge et la durée de l'asthme (F=l,60, p=0,21) (37).
Plus récemment, Taylor et collaborateurs adressèrent l'association entre l'obésité et la
sévérité de l'asthme dans une étude comprenant 3095 sujets d'âge, d'ethnie et de milieux
diversifiés (38). Parmi les sujets obèses, 24,2% [IC95% 20,5-27,9%] présentaient un
asthme classé comme sévère selon les critères des lignes directrices de Y Initiative Globale
pour l'asthme contre 15,1% [IC95% 8,0-13,1] chez les sujets de poids santé (OR 1,42
[IC95% 1,05-1,90]) (tableau 3). De plus, 10,5% [IC95% 8,0-13,1] des sujets obèses10 présentaient un asthme jugé comme en rémission contre 18,2% [14.7-21,8] des sujets de poids santé (OR 0,56 [IC95% 0,38-0,82]. Cette étude, méthodologiquement adéquate, apporte donc une preuve intéressante prônant une association entre l'obésité et un asthme plus sévère. Bien que les mécanismes par lesquels l'obésité pourrait jouer un rôle sur la sévérité de l'asthme soient inconnus, un asthme plus sévère chez la personne obèse suggère un phénotype différent de la maladie dans ce groupe. Sans être plus sévère, une perception plus grande ou un contrôle diminué des symptômes d'asthme en présence d'obésité pourrait également expliquer ces résultats. 4.3 La maîtrise de l'asthme Le contrôle de l'asthme semble plus difficile à obtenir en présence d'obésité. En effet, Saint-Pierre et collaborateurs démontrèrent que les personnes souffrant d'embonpoint et d'obésité et ayant initialement un mauvais contrôle de leur asthme étaient plus susceptibles de demeurer mal contrôlées et ce, malgré l'initiation d'un traitement pharmacologique (39). De leur côté, Lavoie et collaborateurs trouvèrent un moins bon contrôle rapporté de l'asthme avec l'augmentation de l'IMC (37) alors que Peters-Golden et son équipe démontrèrent que, sous placebo, les sujets obèses ou souffrant d'embonpoint présentaient moins de jours de contrôle de leur asthme que les asthmatiques non-obèses, même après ajustement pour la sévérité de l'asthme (40). Finalement, Taylor et collaborateurs trouvèrent que les sujets obèses, lorsque comparés à des sujets de poids santé, présentaient davantage de symptômes quotidiens, utilisaient davantage les soins de santé, prenaient plus régulièrement f^-agonistes à courte durée d'action et manquaient davantage de jours de travail en raison de leur asthme (38). Ceci dit, la raison du mauvais contrôle de l'asthme chez la personne obèse demeure inconnue. L'obésité, par des mécanismes physiopathologiques encore obscurs, pourrait modifier un état asthmatique déjà présent ou encore mener directement à un phénotype d'asthme différent. Dans les deux cas, l'utilité du traitement actuel de l'asthme risquerait d'être diminuée, menant secondairement à un moins bon contrôle de la maladie. Il sera
11
question, dans la section suivante, de la réponse à la médication chez les patients
asthmatiques obèses.
4.4 L a réponse à la médication
Deux catégories d'agents thérapeutiques sont principalement utilisées pour contrôler
l'asthme: les bronchodilatateurs et les anti-inflammatoires.
Tableau 4 : Résumé des agents thérapeutiques utilisés pour maîtriser l'asthme
BRONCHODILATATEURS
Courte durée d'action Salbutamol (Airomir®, Ventolin®)
Terbutaline (Bricanyl®)
Fénotérol (Berotec®)
Longue durée d'action Salmétérol (Serevent®)
Formotérol (Foradil®, Oxeze®)
ANTI-INFLAMMATOIRES
Corticostéroïdes Fluticasone (Flovent®)
Budésonide (Pulmicort®)
Béclométhasone (Qvar®)
Ciclésonide (Alvesco®)
Anti-leucotriènes Montelukast (Singulair®)
Zafirleukast (Accolate®)
COMBINÉS (bronchodilatateur courte durée d'action + corticostéroïdes)
Salmétérol et fluticasone (Advair®)
Formétérol et Bunésonide (Symbicort®)
L'impact de l'obésité sur la réponse au bronchodilatateur est difficile à évaluer. Tel que
démontré dans l'étude de Aaron et collaborateurs, seulement 16,3 % des sujets avec un
diagnostic d'asthme avaient une augmentation significative de leur VEMS après la prise
d'un (32-agoniste à courte durée d'action, malgré un diagnostic d'asthme positif au test à la
métacholine (36). Ce pourcentage était comparable entre les sujets obèses et non-obèses,
suggérant une sensibilité similaire au pVagoniste. Il serait intéressant toutefois de12 comparer, entre les sujets obèses et non-obèses, l'efficacité du P2-agoniste en contexte de bronchospasme. La réponse au traitement anti-inflammatoire de l'asthme semble quant à elle affectée par la présence d'obésité. Dans l'étude de Peters-Golden et collaborateurs, le pourcentage de jours de contrôle de l'asthme chez les patients traités avec du béclométhasone diminuait avec l'IMC, mais de façon non-significative après ajustement pour la réponse au placebo (40). Relativement au placebo toutefois, le pourcentage de jours de contrôle chez les patients traités avec le montelukast augmentait de façon significative avec l'IMC, suggérant un rôle important des leucotriènes dans les symptômes d'asthme chez la personne obèse. Boulet et Franssen démontrèrent que les sujets obèses, principalement les sujets obèses morbides, obtenaient un moins bon contrôle de leur asthme après 12 semaines de traitement avec du fluticasone ou avec une combinaison de fluticasone et salmétérol (41). D'autres études sont cependant nécessaires pour préciser le traitement optimal de l'asthme chez la personne obèse. Plusieurs hypothèses peuvent être générées pour expliquer les observations ci-haut mentionnées. Notons à titre d'exemple l'impact mécanique de l'obésité qui pourrait reproduire certains symptômes d'asthme non soulagés par la médication. L'obésité pourrait également mener à un type d'inflammation distinct au niveau des voies respiratoires, ne répondant pas aussi bien à la médication actuelle. 4.5 L'inflammation des voies respiratoires L'inflammation des voies respiratoires dans l'asthme est classiquement associée avec une prédominance d'éosinophiles et de lymphocytes T, principalement du type CD4+, exprimant de façon prédominante des cytokines de type Th2 (16). Jusqu'à récemment, peu d'évidences suggéraient un type ou un niveau d'inflammation différent chez la personne obèse asthmatique.
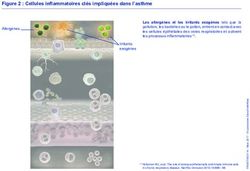
Figure 1 : Inflammation bronchique et asthme
Asthme
Remodelage
bronchique ?
Macrophage
Au cours des premières études sur le sujet, la concentration d'oxyde nitrique dans l'air
expiré (FENO) était utilisée comme marqueur de l'inflammation au niveau des voies
respiratoires. La FENO corrèle positivement avec le niveau d'inflammation bronchique, le
pourcentage d'éosinophiles dans l'expectoration induite et l'hyperréactivité bronchique
(42). Les résultats obtenus, le plus probablement secondaire aux petites tailles
d'échantillon et aux différences méthodologiques entre les études, étaient toutefois très
hétérogènes. Alors que De Winter-de Groot et collaborateurs trouvèrent une association
entre la FENo et l'IMC parmi 24 sujets sains (43), Kazaks et son équipe trouvèrent une
association entre l'IMC et la FENO seulement chez les sujets sains mais pas chez les sujets
asthmatiques (44). Us conclurent que l'inflammation bronchique liée à l'asthme était peut-
être assez sévère pour masquer l'inflammation secondaire à l'obésité. D'autres études, qui
ne seront pas discutées ici, ne trouvèrent pas d'association entre l'IMC et la FENO, autant
chez l'adulte que chez l'enfant, asthmatique ou non (45-50).
La première étude utilisant le test d'expectoration induite fut publiée par Todd et
collaborateurs en 2007 (51). Parmi les 727 sujets de l'étude avec un IMC entre 14,4 et 55
kg/m", 163 étaient asthmatiques. Pour participer, les sujets devaient avoir des symptômes
respiratoires stables. Aucune association significative ne fut trouvée entre l'IMC et les14 cellules de l'expectoration induite, soient les éosinophiles, les neutrophiles, les macrophages et les lymphocytes, autant chez les asthmatiques que chez les non- asthmatiques. De son côté, VanVeen et collaborateurs étudièrent les expectorations induites de 136 sujets avec un asthme difficile à traiter (52). Ils trouvèrent une corrélation négative entre l'IMC et les éosinophiles dans l'expectoration induite (r=-0,36, p
15
voies respiratoires différent chez certaines personnes obèses, des études additionnelles sont
nécessaires pour clarifier ces observations.
La prochaine section s'intéresse aux mécanismes physiopathologiques par lesquels
l'obésité pourrait mener à l'asthme. La façon dont le profil inflammatoire lié à l'obésité
pourrait contribuer au développement ou à la sévérité de l'asthme sera principalement
traitée.
5. Influence de l'obésité sur le développement de l'asthme ;
mécanismes possibles
Même si plusieurs hypothèses ont été soulevées, les mécanismes physiopathologiques par
lesquels l'obésité pourrait mener à l'asthme demeurent inconnus. La figure suivante
présente quelques unes de ces hypothèses.
Figure 2 : Mécanismes possiblement impliqués dans la relation entre l'asthme et l'obésité
Asthme Obésité
1. Profil génétique
ASTHME 2. Conditions in utero OBESITE
3. Alimentation
Obésité —> Asthme
1. Effet hormonal
2. Fonction respiratoire
3. Inflammation systémique
4. Co-morbidités
5. Atopie
6. Perception des symptômes
Asthme —» Obésité
Diminution de l'exercice
Corticostéroïdes oraux
SYMPTOMES
SEMBLABLES
À L'ASTHME
D'une part, il a été suggéré que la tendance à développer de l'obésité et de l'asthme
pourraient être hérités simultanément, tel que démontré par la présence d'un profil16 génétique commun (54;55), de conditions in utero particulières (56) ou encore d'une alimentation riche en matière grasse et pauvre en certains nutriments (57-59). La possibilité que l'asthme puisse mener à l'obésité, soit en favorisant la sédentarité ou par l'emploi de corticostéroïdes inhalés a quant à elle été réfutée comme principale cause de cette relation (2;60). Suite aux études longitudinales, la possibilité que l'obésité soit un facteur causal de l'asthme chez la personne obèse a augmenté en popularité. Par exemple, il a été suggéré que l'obésité puisse mener à l'asthme via une exposition accrue aux oestrogènes (61 ;62), un effet sur le développement de l'atopie (20) ou encore par le biais de co-morbidités telles le reflux gastro-oesophagien (63) et l'apnée du sommeil (64). Le changement dans la fonction respiratoire et l'inflammation systémique de bas grade retrouvés en présence d'obésité pourraient également être à l'origine de l'asthme chez la personne obèse. 5.1 Fonction respiratoire L'obésité est associée à une diminution du VEMS et de la capacité vitale forcée (CVF) (65). Le ratio VEMS/CVF est conservé, sauf chez les obèses morbides où il diminue (65). Typiquement, le volume de réserve expiratoire (VRE) et la capacité résiduelle fonctionnelle (CRF) sont diminués chez la personne obèse, cette dernière respirant à plus bas volume respiratoire (65). Il a été suggéré que les changements au niveau de la fonction respiratoire en présence d'obésité puissent être impliqués dans l'asthme chez la personne obèse. D'une part, le fait de respirer à plus bas volume pulmonaire a été associé avec une augmentation de la réactivité bronchique (66). La diminution des volumes pulmonaires chez la personne obèse pourrait donc, du moins en partie, expliquer l'incidence plus élevée d'hyperréactivité bronchique dans ce groupe (67;68). D'autre part, l'inspiration profonde et les forces péri-bronchiques qu'elle génère constituent un bronchodilatateur puissant (69;70). Tel que démontré par Boulet et collaborateurs, l'obésité semble associée à une réduction de l'effet bronchodilatateur d'une inspiration profonde, prédisposant la personne obèse à l'hyperréactivité bronchique (71 ).
17
5.2 Inflammation systémique
Le tissu adipeux est un organe endocrinien sécrétant plusieurs cytokines, chémokines et
hormones régulatrices à la base d'une inflammation chronique de bas grade chez la
personne obèse (72). Par des mécanismes encore inconnus, cette dernière pourrait avoir un
rôle à jouer dans le développement ou le phénotype d'asthme chez la personne obèse.
Figure 3 : Principales adipokines augmentées dans le sérum en présence d'obésité
Cytokines Ç~ Chémokines
TNF-a i=> IL-8
Protéines de phase aiguë
Sérum amyloïde A
IL-1 MCP-1 Protéine-C réactive
IL-6 M1F-1 a PAI-1
Visfatine Eotaxine >>
Glycoprotéine al-acide
IL-IO Fibrinogène
TGF-P Hormones régulatrices18 la souris, l'administration exogène de leptine entraîne une hyperréactivité bronchique à l'ovalbumine (77). Plusieurs hypothèses ont été émises pour expliquer comment le niveau de leptine sérique pourrait influencer le développement ou le phénotype de l'asthme chez la personne obèse. D'une part, il a été suggéré que la leptine pourrait conduire à l'asthme en favorisant un type d'inflammation bronchique différent de celui typiquement retrouvé. L'inflammation bronchique retrouvée dans l'asthme allergique est habituellement médiée par les lymphocytes Th2 (16). Lorsqu'exposés à la leptine, la differentiation des lymphocytes T augmente, la synthèse des cytokines de type Thl prédominant toutefois sur celle des cytokines Th2 (78). Chez les souris, l'augmentation de l'hyperréactivité bronchique à l'ovalbumine secondaire à la leptine est également associée à une production accrue d'immunoglobulines E (IgE) (77). In vitro chez des macrophages de rats, la leptine a été démontrée comme pouvant induire la synthèse de leucotriènes (79). Les leucotriènes sont des médiateurs inflammatoires ayant la capacité de produire une contraction du muscle bronchique 3 à 4 fois plus forte et plus longue que celle secondaire à l'histamine (80). Aucune étude ne s'est intéressée à la présence de leptine localement au niveau des voies respiratoires en présence d'asthme. Le lien entre l'inflammation bronchique et le niveau sérique de leptine chez l'humain demeure également peu étudié. Alors que Sood et collaborateurs ne trouvèrent pas de différence dans les niveaux sériques de leptine après provocation allergénique entre 8 sujets asthmatiques et 6 contrôles (81 ), Sutherland et ses collègues ne trouvèrent pas d'interaction entre l'obésité et le type d'inflammation bronchique standard retrouvé dans l'asthme (53). D'autre part, il a été suggéré que la leptine favoriserait le développement de l'asthme via une action sur les centres respiratoires. En effet, un niveau élevé de leptine sérique a été associé à une diminution de la commande respiratoire centrale et à une réponse hypercapnique (82;83). Ainsi, la résistance à la leptine retrouvée chez la personne obèse pourrait également s'appliquer aux centres de commande respiratoire. Des études subséquentes sont nécessaires.
19 5.2.2 Adiponectine L'adiponectine est une hormone anti-inflammatoire produite par le tissu adipeux. Paradoxalement, les niveaux plasmatiques d'adiponectine sont diminués en présence d'obésité (84). Les niveaux d'adiponectine sérique semblent également diminués en présence d'asthme, sans toutefois expliquer la relation entre l'asthme et l'obésité. En effet, Sood et collaborateurs trouvèrent un niveau d'adiponectine sérique plus bas chez les femmes asthmatiques que chez celles non-asthmatiques (85). L'association entre l'obésité et l'asthme n'était par contre que très peu affectée par l'ajustement pour le niveau d'adiponectine sérique (85). À l'opposé, Jang et ses collègues ne trouvèrent pas de différence dans les niveaux sériques d'adiponectine entre 60 sujets asthmatiques et 30 sujets normaux (75). Chez des modèles de souris avec un asthme allergique, il a été démontré que le traitement avec de l'adiponectine recombinante diminue l'inflammation et F hyperréactivité bronchique (86). De plus, les provocations allergéniques semblent diminuer l'expression de l'adiponectine par les adipocytes, suggérant un rôle de la diminution de cette hormone dans l'expression des symptômes allergiques (86). Ainsi, un bas niveau d'adiponectine pourrait à la fois contribuer et être le résultat d'un asthme allergique. Chez l'humain toutefois, bien que les niveaux sériques d'adiponectine étaient plus bas chez les sujets asthmatiques que chez les non-asthmatiques, Sood et collaborateurs ne trouvèrent aucune différence dans la diminution de ces niveaux 24 heures après une provocation allergénique (81). Les mécanismes par lesquels la diminution de l'adiponectine pourrait mener à l'asthme n'est pas claire. D'une part, l'adiponectine induit la sécrétion d'IL-10 et d'antagoniste endogène du récepteur pour l'IL-1 (87), bloquant ainsi la production de TNF-a, d'interféron-y, d'IL-4 et d'autres cytokines Th2. La diminution de l'adiponectine sérique pourrait donc contribuer à l'inflammation typiquement retrouvée dans l'asthme via la perte de ces mécanismes protecteurs. D'autre part, l'adiponectine possède la capacité d'induire une vasorelaxation endothelial (88) et d'inhiber la prolifération et la migration des cellules musculaires lisses vasculaires en culture (89-91). Puisque des récepteurs adipoRl et adipoR2 sont présents dans les cellules musculaires lisses bronchiques humaines en culture (36). il a été suggéré que l'adiponectine puisse avoir un rôle à jouer dans la bronchorelaxation.
20 5.2.3 Autres D'autres adipokines augmentées dans le sérum en présence d'obésité pourraient également avoir un rôle à jouer dans l'asthme chez la personne obèse. Par exemple, le TNF- a a été associé à 1"hyperréactivité bronchique chez l'humain (92) et les médicaments bloquant son effet au niveau systémique semblent améliorer la fonction respiratoire et diminuer les exacerbations des patients souffrant d'asthme (93;94). L'IL-6 est également augmenté en présence d'obésité. Lors d'un traitement avec un anticorps anti-IL-6, l'hyperréactivité bronchique innée chez les souris obèses diminue de façon significative, ce qui ne semble pas le cas chez les souris non-obèses (95). Conclusion de la section Les mécanismes physiopathologiques expliquant la relation entre l'obésité et l'asthme demeurent obscurs. À l'heure actuelle, les études longitudinales pointent vers l'obésité comme un des facteurs causals de l'asthme, ou du moins comme facteur favorisant son développement. La part des changements hormonaux et des co-morbidités associées à l'obésité dans le développement ou le phénotype de l'asthme ainsi que l'impact de l'obésité sur l'atopie demeurent peu étudiés. La diminution des volumes pulmonaires (96) et de l'effet bronchodilatateur d'une inspiration profonde en présence d'obésité (71) pourrait avoir un rôle à jouer dans l'asthme chez la personne obèse. L'inflammation systémique de bas grade, notamment l'augmentation de la leptine et la diminution de l'adiponectine sérique, constitue un autre maillon pouvant être à l'origine ou conduire à un asthme différent chez la personne obèse. Il est à noter que même si ces hypothèses sont détaillées séparément, il est probable qu'aucune d'entre elles ne soit mutuellement exclusive, la relation entre l'obésité et l'asthme étant probablement multifactorielle.
Vous pouvez aussi lire