Étude de l'effet d'une matrice à base de collagène sur la différenciation des cellules souches de la pulpe dentaire en odontoblastes - Corpus UL
←
→
Transcription du contenu de la page
Si votre navigateur ne rend pas la page correctement, lisez s'il vous plaît le contenu de la page ci-dessous
Étude de l'effet d'une matrice à base de collagène sur la
différenciation des cellules souches de la pulpe dentaire
en odontoblastes
Mémoire
Maryse Boisvert
Maîtrise en sciences dentaires - endodontie - avec mémoire
Maître ès sciences (M. Sc.)
Québec, Canada
© Maryse Boisvert, 2019Étude de l’effet d’une matrice à base de collagène sur la différenciation des
cellules souches de la pulpe dentaire en odontoblastes
Mémoire
Maryse Boisvert
Sous la direction de :
Dr Mahmoud Rouabhia, directeur de recherche
Dre Juliana Nascimento Santos, codirectrice de rechercheRésumé
La thérapie canalaire occasionne à la dent traitée une perte de sensibilité et de vitalité. La
dent n’est plus en mesure de combattre une infection éventuelle et reste fragile. Pour une
dent permanente immature nécrosée, la perte de vitalité peut mener à l’arrêt de la
croissance radiculaire. La mise au point d’une technique de régénération est nécessaire
pour guider le processus de différenciation des cellules souches vers le type cellulaire
désiré et permettre de regagner la vitalité du tissu pulpaire. L’étude a pour but d’examiner
si une matrice poreuse à base de collagène permet la différenciation des cellules souches
humaines de la pulpe dentaire (CSPD) en cellules odontoblastiques. Des CSPD ont été
mises en culture avec ou sans facteurs de différenciation odontoblastique, en monocouche
ou en présence de la matrice collagénique. L’adhésion a été observée à 6 et à 24 h. La
prolifération a été étudiée par la technique d’incorporation du bromure 3-(4,5-
diméthylthiazol-2-yl)-2,5-diphényltétrazolium (MTT) à 3 et 5 jours. La morphologie
cellulaire a été visualisée par microscopie optique à 3 et 7 jours. La formation de tissu
calcifié et l’activité de la phosphatase alcaline (ALP) ont été évaluées à 2, 3 et 4 semaines.
La sialophosphoprotéine de la dentine (SPPD) et l’ostéocalcine (OC) ont aussi été
examinées par transfert de protéines. Les résultats montrent que les CSPD adhèrent et
prolifèrent en présence du milieu de différenciation et de la matrice de collagène. Il y a
production d’ALP et de tissu calcifié en présence du milieu de différenciation et de la
matrice de collagène. L’analyse protéique indique la production de SPPD et d’OC,
confirmant la différenciation de CSPD en cellules odontoblastiques au contact de la
matrice de collagène. La matrice de collagène pourrait offrir un microenvironnement
favorisant la différenciation des CSPD en odontoblastes dans le système canalaire in vivo.
iiiAbstract
Root canal therapy results in loss of tooth sensitivity and vitality. The tooth cannot
respond to subsequent infections and become brittle. When permanent teeth become
necrotic at early patient age, the treatment options are limited and the long-term survival
of these teeth is questionable due to the thin, incompletely formed dentin walls and the
minimal crown-root ratio. The regenerative endodontic procedures offer a new treatment
option to promote healing as well as replace the pulp-dentin complex with a possible
recovery of the pulp vitality. The objective of this study was to investigate if a biological
porous collagen scaffold promotes differentiation of human dental pulpal stem cells
(DPSC) into odontoblast-like cells. DPSCs were cultured in standard or differentiation
medium either in monolayer or in contact with a collagen scaffold. The adhesion of
DPSCs was observed at 6 and 24 h. The cell proliferation was studied by using 3-(4,5-
dimethylthiazolyl-2)-2,5-diphenyltetrazolium bromide (MTT) assay, at 3 and 5 days.
Cellular morphology was visualized by optic microscopy at 3 and 7 days. Tissue
mineralization and alkaline phosphatase activity (ALP) were appreciated after 2, 3 and
4 weeks. Dentin sialophosphoprotein (DSPP) and osteocalcin (OC) were examined by
Western blot. The results showed that DPSCs adhere and proliferate in contact with the
collagen scaffold. Production of calcified tissue and ALP were observed when DPSCs
were cultured on the collagen scaffold. Protein analysis demonstrated production of
DSPP and OC, which confirms the presence of odontoblast-like cells when in contact
with the collagen scaffold. Overall, our study demonstrated the potential use of the porous
collagen scaffold to promote DPSC differentiation in odontoblast-like cells in root canal
system in vivo.
ivTable des matières
Résumé ............................................................................................................................iii
Abstract ............................................................................................................................ iv
Liste des figures ............................................................................................................. vii
Liste des abréviations ...................................................................................................viii
Dédicace .......................................................................................................................... xi
Remerciements .............................................................................................................. xii
Introduction ..................................................................................................................... 1
1 Revue de la littérature .................................................................................................... 3
1.1 Problématique clinique ......................................................................................................... 3
1.1.1 Pathogénèse ...................................................................................................................... 3
1.1.2 Causes............................................................................................................................... 4
1.1.2.1 Traumatismes dentaires .......................................................................................... 4
1.1.2.2 Lésions carieuses .................................................................................................... 4
1.1.2.3 Anomalies dentaires congénitales........................................................................... 5
1.2 Complexe pulpo-dentinaire ................................................................................................... 5
1.2.1 Origine .............................................................................................................................. 5
1.2.2 Développement dentaire ................................................................................................... 6
1.2.2.1 Formation radiculaire.............................................................................................. 7
1.2.3 Structure et composition................................................................................................... 8
1.2.3.1 Dentine.................................................................................................................... 8
1.2.3.2 Pulpe ....................................................................................................................... 9
1.3 Modalités de traitement endodontique de la dent permanente immature ........................... 11
1.3.1 Thérapie par apexification .............................................................................................. 11
1.3.1.1 Définition de l'apexification ................................................................................. 11
1.3.1.2 Technique clinique................................................................................................ 11
1.3.1.3 Limitations ............................................................................................................ 12
1.3.2 Thérapie par revascularisation ....................................................................................... 12
1.3.2.1 Définition de la revascularisation ......................................................................... 13
1.3.2.2 Historique ............................................................................................................. 13
1.3.2.3 Technique clinique................................................................................................ 14
1.3.2.4 Limitations ............................................................................................................ 16
1.4 Ingénierie tissulaire ............................................................................................................. 18
1.4.1 Définition ....................................................................................................................... 18
1.4.2 Historique ....................................................................................................................... 19
1.4.3 Éléments clés .................................................................................................................. 19
1.4.3.1 Cellules souches.................................................................................................... 19
1.4.3.2 Matrices ................................................................................................................ 21
1.4.3.3 Biomolécules ........................................................................................................ 23
1.4.4 Éventuelles applications cliniques ................................................................................. 27
1.4.4.1 Parodontie ............................................................................................................. 27
1.4.4.2 Endodontie ............................................................................................................ 28
1.5 Perspectives ......................................................................................................................... 30
1.6 Objectifs de recherche ......................................................................................................... 32
1.6.1 Hypothèses de travail ..................................................................................................... 32
1.6.2 Premier objectif .............................................................................................................. 32
1.6.3 Second objectif ............................................................................................................... 32
1.6.4 Pertinence du projet ........................................................................................................ 32
2 Matériel et méthodes .................................................................................................... 33
2.1 Isolement et culture des cellules souches humaines de la pulpe dentaire ........................... 33
2.2 Effets du milieu de différenciation odontoblastique sur les CSPD ..................................... 34
2.2.1 Culture des CSPD........................................................................................................... 34
2.2.2 Milieu standard ............................................................................................................... 34
2.2.3 Milieu de différenciation odontoblastique ..................................................................... 34
2.2.4 Morphologie des CSPD .................................................................................................. 35
2.2.5 Prolifération des CSPD .................................................................................................. 35
2.3 Comportement des CSPD en présence de la matrice biologique à base de collagène ........ 36
2.3.1 Adhésion des CSPD ....................................................................................................... 37
2.3.2 Prolifération des CSPD .................................................................................................. 37
v2.3.3 Activité de la phosphatase alcaline (ALP) des CSPD .................................................... 37
2.3.4 Production protéique par les CSPD ................................................................................ 37
2.3.4.1 Extraction et dosage protéique.............................................................................. 38
2.3.4.2 Transfert de protéines ........................................................................................... 38
2.4 Calcification tissulaire produite par la prolifération des CSPD .......................................... 39
2.4.1 Évaluation qualitative ..................................................................................................... 39
2.4.2 Évaluation quantitative ................................................................................................... 39
2.5 Analyses statistiques ........................................................................................................... 40
3 Résultats......................................................................................................................... 41
3.1 Étude de l’effet du milieu de différenciation odontoblastique sur les CSPD ..................... 41
3.1.1 Morphologie des CSPD .................................................................................................. 41
3.1.2 Prolifération des CSPD .................................................................................................. 42
3.2 Évaluation de la matrice biologique à base de collagène sur les CSPD ............................. 43
3.2.1 Adhésion des CSPD ....................................................................................................... 43
3.2.2 Prolifération des CSPD .................................................................................................. 43
3.2.3 Activité de la phosphatase alcaline (ALP) des CSPD .................................................... 45
3.2.4 Production protéique par les CSPD ................................................................................ 46
3.2.4.1 Protéine non spécifique à la différenciation odontoblastique ............................... 46
3.2.4.2 Protéine spécifique à la différenciation odontoblastique ...................................... 47
3.3 Calcification tissulaire en présence de la matrice biologique poreuse à base de collagène 49
3.3.1 Évaluation qualitative ..................................................................................................... 49
3.3.2 Évaluation quantitative ................................................................................................... 49
4 Discussion ...................................................................................................................... 51
Conclusion .............................................................................................................................. 57
Bibliographie/médiagraphie ......................................................................................... 58
viListe des figures
FIGURE 1. MATURATION RADICULAIRE ........................................................................................................ 8
FIGURE 2. SCHÉMA REPRÉSENTANT UN GROSSISSEMENT DU COMPLEXE PULPO-DENTINAIRE D’APRÈS A.
NANCI, TEN CATE’S HISTOLOGY. ................................................................................................................ 11
FIGURE 3. SCHÉMA EXPLICATIF DES ÉTAPES DE LA REVASCULARISATION. . ............................................... 16
FIGURE 4. ILLUSTRATION DE LA MANDIBULE QUI DÉMONTRE LES SOURCES DE CELLULES SOUCHES
DENTAIRES LES PLUS IMPORTANTES. ........................................................................................................... 21
FIGURE 5. ILLUSTRATION DU POTENTIEL D’ACTION DES IRRIGANTS ET MÉDICAMENTS DANS LE RELARGAGE
OU L’EXPOSITION DE MOLÉCULES BIOACTIVES SÉQUESTRÉES DANS LA DENTINE ........................................ 26
FIGURE 6. SCHÉMA EXPLICATIF POUR L’ÉTUDE DES EFFETS DU MILIEU DE DIFFÉRENCIATION
ODONTOBLASTIQUE SUR LES CSPD ............................................................................................................. 35
FIGURE 7. SCHÉMA EXPLICATIF DES ÉTAPES POUR ÉTUDIER L’EFFET DE LA MATRICE BIOLOGIQUE À BASE
DE COLLAGÈNE SUR LES CSPD .................................................................................................................... 36
FIGURE 8. EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE SUR LA MORPHOLOGIE DES CSPD. .
..................................................................................................................................................................... 41
FIGURE 9. EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE À 3 ET 5 JOURS SUR LA
PROLIFÉRATION DES CSPD EN MONOCOUCHE (2 D). ................................................................................... 42
FIGURE 10. EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE SUR L’ADHÉSION DES CSPD SUR
COLLATAPEÔ.. ........................................................................................................................................... 43
FIGURE 11. EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE À 3 ET 5 JOURS SUR LA
PROLIFÉRATION DES CSPD AU SEIN DU COLLATAPEÔ. .............................................................................. 44
FIGURE 12. EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE SUR L’ACTIVITÉ DE LA
PHOSPHATASE ALCALINE SUR LES CSPD SUR COLLATAPEÔ À 2, 3 ET 4 SEMAINES. ................................... 45
FIGURE 13. PRODUCTION D’OSTÉOCALCINE PAR LES CSPD SUR COLLATAPEÔ À 3 SEMAINES................. 46
FIGURE 14. EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE SUR LES CSPD EN MONOCOUCHE
(2 D) OU ENSEMENCÉS SUR COLLATAPEÔ (3 D) POUR LA PRODUCTION DE SPPD À 2, 3 ET 4 SEMAINES. ... 48
FIGURE 15. ÉVALUATION QUALITATIVE DE L’EFFET DU MILIEU DE DIFFÉRENCIATION ODONTOBLASTIQUE À
2, 3 ET 4 SEMAINES SUR LA FORMATION DE TISSU CALCIFIÉ PAR LES CSPD ENSEMENCÉS DANS LE
COLLATAPEÔ. . .......................................................................................................................................... 49
FIGURE 16. QUANTIFICATION DE LA PRODUCTION DE TISSU CALCIFIÉ PAR LES CSPD CULTIVÉES AU
CONTACT DE LA MATRICE BIOLOGIQUE POREUSE À BASE DE COLLAGÈNE COLLATAPEÔ À 3 ET 4 SEMAINES.
..................................................................................................................................................................... 50
viiListe des abréviations
a-MEM Milieu minimal essentiel
°C Degré Celcius
µg Microgramme
µL Microlitre
2D En deux dimensions ou monocouche
3D En trois dimensions
AAE American association of endodontists
ADN Acide désoxyribonucléique
ALP Activité de la phosphatase alcaline
ANOVA Analyse de la variance
ARN Acide ribonucléique
ARS Rouge d’Alizarine S
BMP Protéines morphogénétiques osseuses
BMSC Cellules souches de la moëlle osseuse
BSA Albumine de sérum bovin
BSP Sialoprotéine osseuse
Ca(OH)2 Hydroxyde de calcium
Ca2+ Ion calcium
CD Groupe de désignation ou déterminant de classification
CO2 Dioxyde de carbone
Coll. Collaborateurs
CPC Chlorure de cétylpyridinium
CSPD Cellules souches de la pulpe dentaire
DFSC Cellules souches du follicule dentaire
DGP Glycoprotéine dentinaire
DMEM Dulbecco-Vogt’s modified Eagle’s
DMP-1 Phosphoprotéine de matrice dentinaire
DPP Phosphoprotéine dentinaire
DSP Sialoprotéine dentinaire
EDTA Acide tétra-acétique éthylènediamine
EGF Facteur de croissance épidermique
ÉLISA Dosage d’immunoabsorption par enzyme liée
ET Écart-type
FBS Sérum bovin foetal
FGF-2 Facteur de croissance fibroblastique 2
G-CSF Facteur stimulant les colonies de granulocytes
H Heure
H Ham’s F-12
H2O2 Peroxyde d’hydrogène
viiiHA/TCP Hydroxyapatite et phosphate tricalcique
HCl Acide chlorhydrique
HLA-A Protéine du complexe majeur d’histocompatibilité de classe 1
HLA-DR Antigène de classe II du leucocyte humain
IGF-1 Facteur de croissance insulinomimétique 1
IRM Imagerie par résonnance magnétique
kDa Kilo Dalton
LPS Lipopolysaccharide
M Molaire
MD Milieu de culture de différenciation odontoblastique
MEC Matrice extracellulaire
MEPE Phosphoprotéine de la matrice extracellulaire
Min Minute
mL Millilitre
mM Millimolaire
MS Milieu de culture standard
MSC Cellules souches d’origine mésenchymateuse
MTA Mineral trioxyde aggregate
MTT Bromure [3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium]
N Normale
NaCl Chlorure de sodium
NaOCl Hypochlorite de sodium
NaOH Hydroxyde de sodium
NGF Facteur de croissance neuronal
nNm Nanomètre
Nmol Nanomole
OC Ostéocalcine
OPN Ostéopontine
PBS Tampon phosphate salin
PCL Poly (e-caprolactone)
PDGF Facteur de croissance dérivé des plaquettes
PDLSC Cellules souches du ligament parodontal
PGA Acide polyglycolique
pH Potentiel hydrogène
PLGA Acide poly(lactique-co-glycolique)
PLLA Acide poly-L-lactique
PNPP Sel disodium p-nitrophényl phosphate
RPM Révolution par minute
RT-PCR Real time polymerase chain reaction
RUNX-2 Run-related transcription factor 2
S Semaine
ixSBF Sérum bovin fœtal
SCAP Cellules souches de la papille apicale
SDS Sodium dodécyl-sulfate
SDS-PAGE Sodium dodécyl-polyacrylamide d’électrophorèse
SHED Cellules souches de dents primaires exfoliées
SIBLINGS Small integrin binding ligand N-linked glycoproteins
Souris nude Souris immunocompromise
SPPD Sialophosphoprotéine de la dentine
SVF Sérum de veau fœtal
TBS Tampon TRIS salin
TGF Facteurs de croissance transformants
TGPC Cellules souches du germe dentaire
TWIST-1 Twist-related protein-1
V Volt
v/v Volume/volume
VEGF Facteur de croissance de l’endothélium vasculaire
X Fois
xDédicace
À Guillaume et Béatrice
xiRemerciements
La présence de personnes clés qui m’ont encadré et entouré au Groupe de Recherche en
Écologie Buccale (GREB) à la faculté de médecine dentaire m’a permis de mener à bien
mon projet de maîtrise en sciences dentaires dans le cadre de ma spécialisation en
endodontie.
D’abord, je tiens à remercier chaleureusement Dr Mahmoud Rouabhia qui s’est toujours
rendu disponible afin de me guider dans mon projet de recherche. Je retiens de cette
expérience vos précieux conseils et explications qui m’ont permis à la fois d’effectuer les
manipulations en laboratoire mais aussi de bien comprendre la portée de mon projet.
Je remercie Dre Juliana Nascimento Santos pour sa gentillesse et sa rigueur dans le but
de mener à bien mon projet de maîtrise.
Je remercie Dr Philippe Gauthier pour ses judicieux conseils et sa rigueur dans
l’évaluation de mon projet de maîtrise.
Je remercie Dr Ze Zhang pour avoir accepté chaleureusement de siéger sur mon comité
d’encadrement. Vous m’avez donné de bons conseils et de bonnes explications pour le
volet des matrices dans le cadre de mon projet de recherche.
Je remercie l’ensemble des membres du GREB et en particulier les membres de mon
équipe de recherche : HyunJin, Mabrouka, Humidah et Amine pour leur accueil
chaleureux au laboratoire et leurs précieux conseils.
xiiIntroduction
La thérapie endodontique fait partie des options de traitement pour conserver une dent
permanente, même après un diagnostic de nécrose pulpaire. Le système canalaire est
désinfecté et scellé avec un matériel d’obturation inerte. La dent perd sa sensibilité et sa
vitalité. Celle-ci ne peut plus combattre une infection éventuelle et devient plus fragile
qu’une dent naturelle.(1) Lorsqu’une dent permanente en développement est affectée
d’une nécrose pulpaire, elle pose un défi clinique pour l’endodontiste et le dentiste
généraliste.(2) Par ailleurs, si le traitement est un échec et que la perte de la dent se produit
lorsque la maturation squelettique est incomplète, le patient n’est pas un bon candidat
pour l’implant dans l’immédiat.(3) Il est possible de traiter ces dents par apexification(4),
par contre ce traitement a comme conséquence l’arrêt de la croissance des racines. Les
procédures d’endodontie régénérative font partie des nouvelles options permettant à la
fois de traiter l’infection, mais aussi de régénérer le complexe pulpo-dentinaire et
possiblement de regagner la vitalité de la pulpe dentaire. La mise au point de la technique
est nécessaire pour permettre de guider le processus de différenciation des cellules
souches vers le type cellulaire désiré selon la situation clinique.
Les sections approfondies dans l’introduction incluent la problématique clinique de la
dent permanente nécrosée et les défis de traitement qu’elle comporte lorsque sa
maturation radiculaire est incomplète. Un survol de la pathogénèse et des différentes
causes de la nécrose pulpaire offre au lecteur la possibilité de comprendre l’origine de la
problématique. Les principales causes menant à une pathologie pulpaire sont le
traumatisme dentaire, la carie ou les anomalies développementales telles une dens
evaginatus et une dens invaginatus.
Par la suite, une revue de la formation et de la composition du complexe pulpo-dentinaire
favorise la compréhension des structures de l’endodonte à régénérer. Les étapes de
l’odontogénèse incluent la lamina, le bourgeon, le capuchon et la cloche dentaire. Le
processus menant à la maturation radiculaire est revu. Le contenu et la structure du
complexe pulpo-dentinaire sont aussi révisés. Les étapes menant à la formation dentaire
ainsi que la composition des tissus dentinaire et pulpaire permettent la compréhension des
implications de la régénération endodontique tissulaire guidée.
Ensuite, un survol de la thérapie conventionnelle par apexification ainsi que la thérapie
actuelle de revascularisation facilitent la compréhension de la problématique clinique liée
au traitement de la dent permanente immature nécrosée. L’apexification n’offre pas la
1possibilité d’assurer l’édification radiculaire. L’historique de la revascularisation est
relaté afin de réaliser que cette technique n’est pas nouvelle et est incluse dans les
procédures d’endodontie régénératives actuelles. La définition ainsi que la technique
clinique de revascularisation sont détaillées. Comme les éléments contenus dans le caillot
sanguin varient d’un individu à l’autre, la revascularisation n’est pas guidée, donc
plusieurs scénarios sont possibles quant à la maturation du tissu pulpaire et dentinaire.
Enfin, le sujet de l’ingénierie tissulaire permet de comprendre la pertinence de chaque
composante nécessaire pour effectuer une régénération tissulaire guidée. Ainsi, les
matrices, les cellules souches et les biomolécules sont les éléments expliqués. Par la suite,
quelques exemples d’applications cliniques de régénération tissulaire guidée disponibles
en médecine dentaire sont exposés. Les perspectives futures permettent au lecteur de
comprendre les objectifs de la régénération endodontique de demain.
21 Revue de la littérature
1.1 Problématique clinique
La médecine dentaire est une branche de la médecine qui prévient, diagnostique et traite
les pathologies bucco-dentaires. L’endodontie est la discipline de la médecine dentaire
qui s’intéresse à la physiologie et aux pathologies de la pulpe dentaire et des tissus
périapicaux. Le traitement de la nécrose pulpaire et de la parodontite apicale constitue un
défi supplémentaire pour l'endodontiste ainsi que le dentiste généraliste, lorsque le
développement des racines de dents permanentes est incomplet.(2) Le défi du clinicien
réside dans le succès du traitement des signes et symptômes de la nécrose pulpaire et de
la parodontite apicale mais aussi dans la préservation de la dent dans la cavité buccale à
long terme. L’inachèvement de la formation des racines est synonyme d’apex ouverts et
de racines courtes et fragiles, ce qui compromet le pronostic de la dent. La fragilité de ces
dents traitées peut mener à leur perte prématurée. La perte d'une dent permanente
immature chez un jeune patient en dentition mixte mène à la perte de fonction, altère la
croissance osseuse, crée de l'interférence avec la phonétique, la respiration et la
mastication, en plus d’un possible impact psychologique préjudiciable.(5,6) Par ailleurs,
le remplacement de la dent par un implant est contre-indiqué à ce moment puisque le
développement cranio-facial est incomplet, donc les options de traitement pour un jeune
patient restent très limitées.(3)
1.1.1 Pathogénèse
Le tissu pulpaire d’une dent peut être endommagé par une invasion bactérienne et/ou un
traumatisme dentaire. La pulpe devient inflammée et si le processus inflammatoire n’est
pas contrecarré, la nécrose pulpaire survient. Durant le processus d’inflammation
pulpaire, les cellules pulpaires initient une réponse de défense pour neutraliser l’infection
et favoriser la guérison tissulaire. Par contre, la chambre pulpaire est un environnement
restreint qui limite l’enflure. Ainsi le drainage lymphatique est limité et peut influencer
négativement la suite du processus inflammatoire. Les odontoblastes, localisés en
périphérie de la pulpe, sont les premières cellules en contact avec les bactéries et leurs
produits métaboliques ayant envahis le tissu pulpaire. Durant la nécrose pulpaire, la mort
des odontoblastes primaires survient provoquant ainsi l’interruption du développement
radiculaire.(1) L'infection qui survient lors d’une nécrose pulpaire est composée
principalement de bactéries Gram négatives anaérobiques, lesquelles induisent une
réaction inflammatoire périapicale L'infection pulpaire est un processus dynamique, et
3différentes espèces bactériennes dominent selon le stade de l'infection. L'oxygène devient
éventuellement non disponible avec l'interruption de la circulation sanguine pulpaire.
Puisque le tissu pulpaire nécrosé est une source finie de nutriments, éventuellement les
bactéries vont migrer vers la portion apicale du système canalaire et induire une réaction
inflammatoire périapicale.(7)
1.1.2 Causes
Le traumatisme dentaire, la carie ou les anomalies développementales telles une dens
evaginatus et une dens invaginatus peuvent mener la dent permanente à une nécrose
pulpaire.(8)
1.1.2.1 Traumatismes dentaires
Le traumatisme dentaire est reconnu pour être la cause principale de nécrose pulpaire des
dents permanentes immatures.(8) La prévalence des traumatismes de dents permanentes
rapportée se situe entre 2,6 et 35 %(9,10) avec une incidence importante chez les enfants
et adolescents de 7 à 15 ans.(11) La plupart des dents permanentes affectées ont une
maturation incomplète du développement radiculaire. Il y a 50 % de ces dents
traumatisées qui recevront un diagnostic de nécrose pulpaire.(12) Les traumatismes
dentaires touchent les enfants provenant de tous les milieux socio-économiques et
affectent principalement les dents antérieures avec différentes présentations cliniques.
Ces traumatismes peuvent résulter d’une fracture coronaire ou radiculaire, d’une avulsion
ou d’un autre type de luxation.
1.1.2.2 Lésions carieuses
Des lésions carieuses qui exposent la pulpe de dents avec apex immatures surviennent
typiquement avec les 1res et 2èmes molaires. Les 1res molaires font éruption à un âge où les
enfants ne sont pas en mesure d’exercer des mesures d’hygiène buccale adéquates. La
prévalence des caries est plus importante chez les enfants dont le revenu familial moyen
est faible, ces enfants grandissent dans des milieux où les habitudes d’hygiène buccale et
l’alimentation ne sont pas prioritaires. Les caries multiples surviennent chez 21 % des
enfants âgés entre 6 et 11 ans aux États-Unis.(13) Chez les adultes, 92 % des gens âgés
entre 20 et 64 ans ont eu une ou des caries sur leurs dents permanentes.(14) Suivant une
exposition par lésion carieuse profonde traitée ou non, la pulpe peut devenir nécrotique.
À ce moment, le patient peut présenter une parodontite apicale ou non. Les cas confirmés
de parodontite apicale peuvent répondre positivement aux tests périapicaux (percussion
4de la dent et palpation du processus alvéolaire). Il est aussi possible que le patient présente
un abcès périapical avec de l’enflure ou un trajet fistuleux.(15)
1.1.2.3 Anomalies dentaires congénitales
Parmi les anomalies congénitales dentaires, celles qui peuvent résulter en une
dévitalisation de la pulpe dentaire en bas âge sont la dens evaginatus et la dens
invaginatus. Cliniquement et radiologiquement, la dens evaginatus présente un tubercule
composé d’émail et de dentine qui fait protrusion au centre de la table occlusale de
prémolaires mandibulaires (plus commun) ou la surface buccale ou linguale de dents
antérieures maxillaires (moins commun).(16) La prévalence de la dens evaginatus est de
0,5 à 6,4 % selon l’échantillon à l’étude avec une proportion plus importante chez les
asiatiques.(17–19) Cette anomalie occasionne fréquemment une exposition pulpaire
suivant de l’attrition dentaire non pathologique lorsque la dent est en occlusion
fonctionnelle.(17) La majorité des cas se retrouvent rapidement en nécrose pulpaire avec
le développement d’une lésion périapicale et la formation d’un trajet fistuleux.(16,17) La
prévalence de la dens invaginatus varie entre 0,3 et 10% et ces dents peuvent aussi
développer une pathologie pulpaire.(20) Cette dernière est par contre caractérisée par une
anatomie canalaire complexe et la nécrose pulpaire peut se produire à cause des défauts
structurels dans l’émail et dentine, ce qui facilite la contamination par des bactéries de
l’environnement buccal.(20)
1.2 Complexe pulpo-dentinaire
1.2.1 Origine
Il est important de comprendre les étapes menant au développement de la dent pour
comprendre les structures à régénérer. Le développement des dents primaires est initié
entre 6 et 8 semaines in-utero et le développement des dents permanentes est initié entre
20 semaines in-utero et 10 mois postnatal.(21) Les dents sont formées de l’ectoderme
oral et de l’ectomésenchyme, qui lui dérive de la crête neurale. L’ectoderme forme
l’organe de l’émail qui deviendra éventuellement l’émail. La dentine et la pulpe sont tous
deux dérivés de la papille apicale ou dentaire qui elle provient du premier arc branchial
formé de l’ectomésenchyme de la crête neurale crânienne. L’ectoderme interagit ainsi
avec l’ectomésenchyme pour former la dentine, le cément et le ligament parodontal.
Lorsque la dent est formée, une partie de l’ectomésenchyme primitif est incorporé dans
la pulpe dentaire ce qui devient une source de cellules souches.(21)
51.2.2 Développement dentaire
L’odontogénèse comprend plusieurs phases en commençant par la lamina qui consiste en
un épaississement de l’épithélium oral. Par la suite, il y a l'étape du bourgeon dentaire où
les cellules de l’ectomésenchyme se condensent pour former la papille dentaire. Au stade
du capuchon dentaire, l’organe de l’émail et la papille dentaire deviennent encapsulés par
une couche de cellules mésenchymateuses nommée le follicule dentaire. L’étape du
capuchon initie la formation de la couronne dentaire. Par la suite, il y a le stade débutant
de la cloche dentaire qui implique la différenciation de plusieurs types de cellules dont
l’épithélium externe de l’émail, l’épithélium interne de l’émail et les améloblastes. Dans
la région apicale de l’organe dentaire, il y a rencontre entre l’épithélium interne et externe
de l’émail qui forment la zone de réflexion. À ce moment, il y a un échange réciproque
d'information moléculaire entre l'organe dentaire et la papille dentaire. Puis, il y a le stade
avancé de la cloche dentaire où les cellules de l’épithélium interne vont déterminer la
forme de la couronne dentaire.(21) Durant cette phase, il y a aussi la formation radiculaire,
l’emplacement de la papille dentaire devient apical au tissu pulpaire. Ainsi, la papille
dentaire contribue en partie à la formation de la dent et va se convertir en tissu pulpaire.
Les cellules de la papille dentaire en périphérie nouvellement différenciées deviennent
des odontoblastes et les cellules du mésenchyme folliculaire vont se différencier en
cémentoblastes. La papille apicale apparaît être histologiquement distincte de la pulpe.
La papille apicale est un réservoir important de cellules souches d’origine
mésenchymateuses indifférenciées avec une capacité importante de prolifération et de
différenciation en odontoblastes.(22)
Les odontoblastes sont responsables de la synthèse et la sécrétion de la matrice de la
dentine. Lors de la dentinogénèse initiale, les odontoblastes sont différenciés des cellules
de la papille dentaire adjacentes à la membrane basale. La différenciation des
odontoblastes de la papille dentaire est effectuée par l’expression de facteurs de
croissance et de différenciation dans les cellules de l’épithélium interne de l’émail. Les
cellules de la papille dentaire sont petites et indifférenciées et elles montrent un noyau
central et peu d’organelles. Les cellules de la papille dentaire deviennent éventuellement
de la pulpe dentaire. Après la formation de la première couche d'odontoblastes, les
cellules de l'épithélium interne de l’émail reçoivent le signal de se différencier en
améloblastes. À ce moment, elles sont séparées de l’épithélium interne de l’émail par une
zone acellulaire qui contient des fibrilles de collagène. Éventuellement, les cellules de
l’épithélium interne de l’émail changent de polarité et des changements se produisent
6dans la papille dentaire. Les cellules de l’ectomésenchyme se joignent à la zone
acellulaire et s’élargissent et s’allongent pour devenir des préodontoblastes et des
odontoblastes lorsque leur cytoplasme augmente en volume et contient des organelles qui
synthétisent des protéines. La zone acellulaire entre la papille dentaire et l’épithélium
interne de l’émail se comble graduellement par des odontoblastes. Ces cellules sont
hautement polarisées et avec leur noyau en direction opposée à l’épithélium interne de
l’émail. Ensuite, il y a la formation de la matrice organique. Le premier signe est
l’apparition des fibres de Von Korff (fibrilles de collagène type III associées à la
fibronectine) et s’étendent vers l’épithélium interne de l’émail. Par la suite, il y a
formation de fibrilles plus petites de collagène de type I. Dans le contrôle de la
minéralisation de la dentine, il y a présence de l’activité de la phosphatase alcaline (ALP)
et d’adénositriphosphate de calcium à la fin distale et consistante avec l’implication
cellulaire dans le transport et le relargage d’ions minéraux dans la couche de dentine en
formation.(21)
Lorsque l’émail est déposé sur la matrice dentinaire, les améloblastes sont programmés
pour la mort cellulaire. Les odontoblastes vont au contraire rester métaboliquement actifs
tout au long de la vie de la dent. La formation des racines de la dent survient durant la
dernière étape soit celle de l’éruption de la dent dans la cavité buccale.(23)
1.2.2.1 Formation radiculaire
Une dent a besoin d'environ trois années suivant son éruption dans la cavité buccale pour
compléter son développement jusqu'à maturation radiculaire complète.(24) Le début de
la formation radiculaire précède le début de l’éruption dentaire. Lorsque la dent atteint sa
position fonctionnelle dans la cavité buccale, environ 2/3 de la racine y est formé. La
Figure 1 montre la différence entre une dent immature et une dent où l’édification des
racines est complétée. Suivant la formation de la couronne, les cellules de l’épithélium
interne et externe de l’émail prolifèrent et forment la membrane de Hertwig’s. Cette
membrane s’étend autour de la pulpe dentaire jusqu’à sa portion basale. Durant cette
phase de maturation, la dent est caractérisée par un apex ouvert et des murs de dentine
minces. La membrane de Hertwig’s ou diaphragme épithélial serait responsable de la
formation de la dentine radiculaire via un signal aux cellules mésenchymateuses
indifférenciées présentes dans la papille dentaire. La formation de la dentine débute au
stade de la cloche dentaire. La dentine radiculaire requiert la prolifération de la membrane
de Hertwig’s à partir de la zone de réflexion de l’organe de l’émail autour de la pulpe
7pour initier la différenciation des odontoblastes.(21)
Figure 1. Maturation radiculaire
La figure 1A montre une dent permanente avec maturation radiculaire incomplète (dent
immature) et la figure 1B montre une dent permanente avec maturation radiculaire
complète (dent mature).[Tiré de Kaushik et coll.(25)]
1.2.3 Structure et composition
Le complexe pulpo-dentinaire d’une dent est composé de pulpe dentaire dans sa portion
interne et est entouré du tissu dentinaire. L’émail est la couche protectrice de la couronne
et le cément est la couche protectrice de la racine.
1.2.3.1 Dentine
La dentine est un tissu conjonctif avasculaire minéralisé et élastique qui forme le corps
de la dent, c’est une matrice qui ressemble à l’os avec des tubuli dentinaires qui y
traversent toute l’épaisseur. Les tubuli contiennent les prolongements cytoplasmiques des
odontoblastes. La dentine comporte une section nommée prédentine, c’est une matrice
non minéralisée récemment sécrétée par les odontoblastes et qui se minéralise
graduellement en dentine. La dentine mature contient 70 % de matériel inorganique dont
l’hydroxyapatite. Elle contient 20 % de matériel organique et 10 % d’eau. Le matériel
organique est constitué de collagène de type I principalement ainsi que du collagène de
type III, V et VI, des protéines, des lipides et d’une matrice non collagénique. La matrice
8non collagénique est constituée de protéines qui s’accumulent à la périphérie des tubuli
qui jouent un rôle clé dans la minéralisation de la dentine. Les molécules qui y sont
impliquées se nomment les small integrin binding ligand, N-linked glycoproteins
(SIBLINGS) et comprennent la sialoprotéine osseuse (BSP), l’ostéopontine (OPN), la
sialophosphoprotéine de la dentine (SPPD), la phosphoprotéine de la matrice dentinaire
1 (DMP-1) et la phosphoprotéine de la matrice extracellulaire (MEPE). SPPD est traduite
en glycoprotéine dentinaire (DGP), en phosphoprotéine dentinaire (DPP) et en
sialoprotéine dentinaire (DSP). Par ailleurs, la matrice non collagénique contient de
l’ostéocalcine (OC), de l’ostéonectine, des protéoglycans et des protéines sériques.(26)
La dentine primaire recouvre la pulpe et le manteau dentinaire correspond à la couche
externe de dentine dans la portion coronaire de la dent. La dentine secondaire se
développe après la formation radiculaire et représente une déposition continue de dentine
par les odontoblastes avec le même ratio du contenu organique/inorganique que la dentine
primaire localisée dans le plancher et le plafond pulpaire. La dentine tertiaire est produite
en réaction à divers stimuli (attrition, carie et matériel d’obturation).(21)
1.2.3.2 Pulpe
La pulpe dentaire est un tissu conjonctif qui occupe la portion centrale de la dent. La
pulpe dentaire a cinq fonctions dont la production de la dentine qui l’entoure, l’apport de
nutriments à la dentine qui est avasculaire, la protection par la réponse aux stimuli, la
réparation par de la dentine lorsque nécessaire et la fonction sensorielle.
Histologiquement, la pulpe comporte quatre zones dont la zone odontoblastique en
périphérie, la zone de Weil qui est acellulaire, la zone riche en cellules et le corps pulpaire
qui contient les vaisseaux sanguins et les fibres nerveuses. La zone riche en cellules
contient une proportion importante de fibroblastes, des cellules de l’immunité dont des
macrophages et des cellules dendritiques et des cellules souches d’origine
mésenchymateuses indifférenciées. Le corps pulpaire contient principalement des
fibroblastes. Les fibroblastes et les cellules souches pulpaires d’origine mésenchymateuse
ont la capacité de se différencier en cellules odontoblastiques en présence des
biomolécules appropriées. Ainsi, la pulpe dentaire est une bonne source de cellules
souches multipotentes. Le nombre d’odontoblastes correspond au nombre de tubuli
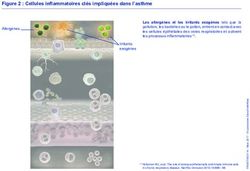
dentinaires. La Figure 2 ci-dessous permet de visualiser les constituants du tissu pulpaire
et dentinaire. Les odontoblastes dans la portion coronaire sont plus larges que ceux
présents dans la racine. Dans la couronne d’une dent mature, les corps d’odontoblastes
9sont en formes de colonnes et mesurent 50 µm de hauteur. La morphologie des
odontoblastes reflète leur stade d’activité (synthèse ou quiescence), ainsi les organelles
d’une cellule active sont proéminentes. La vie d’un odontoblaste équivaut à la durée de
vie de la dent parce que les odontoblastes sont des cellules terminales. Lorsque les
odontoblastes sont différenciés, ils ne peuvent pas se diviser.(23)
À l’occasion, lorsque le tissu pulpaire est sévèrement irrité, il peut y avoir mort
d’odontoblastes. Ainsi de nouvelles cellules sont différenciées et vont migrer au site
d’agression grâce à la différenciation de cellules souches d’origine mésenchymateuses.
À ce moment, de la dentine réparatrice est formée par les cellules odontoblastiques. Les
fibroblastes sont les cellules les plus nombreuses dans la pulpe dentaire, principalement
dans la portion coronaire de la pulpe. Les fibroblastes sont responsables de former et de
maintenir la matrice pulpaire qui est constituée majoritairement de collagène.(21)
Le système canalaire se termine au foramen apical où la pulpe et le ligament parodontal
se rencontrent ainsi que les vaisseaux sanguins et les fibres nerveuses. Dans une dent en
développement, le foramen apical est large et centré et la papille apicale est distincte de
la pulpe dentaire car elle contient moins de composantes cellulaires et vasculaires. La
papille apicale contient aussi des cellules souches pulpaires d’origine mésenchymateuse
qui ont la capacité de se différencier en cellules odontoblastiques.(22)
10Figure 2. Schéma représentant un grossissement du complexe pulpo-dentinaire d’après
A. Nanci, Ten Cate’s histology. [Tiré de Simon et coll.(27)]
1.3 Modalités de traitement endodontique de la dent permanente immature
1.3.1 Thérapie par apexification
La modalité de traitement de dents permanentes immatures nécrosées diffère de la
thérapie endodontique usuelle (traitement de canal) pour traiter les dents matures.
Traditionnellement les dents permanentes immatures sont traitées par apexification.
1.3.1.1 Définition de l'apexification
Selon l'American Association of Endodontists (AAE) l'apexification consiste à induire
une barrière apicale de la dent permanente immature. Cette barrière peut être immédiate
ou calcifiée en quelques mois, et ce pour prévenir l'extrusion du matériel d'obturation
canalaire lors du traitement d’une dent permanente immature nécrosée.
1.3.1.2 Technique clinique
Le traitement est initié en isolant la dent avec une digue dentaire et en gagnant l’accès au
système canalaire. La désinfection et la mise en forme canalaire sont par la suite
effectuées en utilisant une solution d’irrigation pour dissoudre le matériel organique et
11inorganique et détruire la flore bactérienne présente ainsi que ses toxines. Des instruments
manuels de gros calibres sont habituellement utilisés pour la mise en forme en prenant
soin de ne pas affaiblir davantage les parois radiculaires. Un matériel permettant de créer
une barrière apicale est par la suite condensé dans la région du foramen apical. Les
matériaux les plus communément utilisés sont l’hydroxyde de calcium Ca(OH)2(28) et le
mineral trioxyde aggregate (MTA).(29) Le patient est revu dans un deuxième temps afin
de sceller complètement le système canalaire.
Le Ca(OH)2 est doté d’activité antibactérienne à large spectre. De plus, le Ca(OH)2
possède une faible solubilité et un pH élevé. En utilisant le Ca(OH)2, il est nécessaire
d’avoir un contact prolongé pour induire une barrière calcifiée. Ainsi, ce médicament doit
être renouvelé périodiquement pour maintenir ses activités biologiques. Par conséquent,
l'apexification à l'hydroxyde de calcium prend plusieurs visites et se réalise sur une
période de quelques mois, donc requiert la compliance du jeune patient.
Le MTA est composé de silicate de dicalcium et de tricalcium, d’oxyde de bismuth et de
sulfate de calcium. Il est utilisé pour la confection immédiate d’une barrière apicale, ce
qui permet l'obturation canalaire dans une seconde séance d’une dent permanente
immature nécrosée. Il possède une bonne capacité de scellement (30) et il est
biocompatible.(31)
1.3.1.3 Limitations
La technique conventionnelle par apexification offre la possibilité de traiter les signes et
symptômes de la nécrose pulpaire, mais n’assure pas la continuité de la croissance des
racines. De plus, le contact prolongé du Ca(OH)2 sur les parois dentinaires peut altérer
ses propriétés mécaniques et rendre la dent plus susceptible à la fracture.(32) Il est donc
possible que les dents traitées par apexification restent assez fragiles et risquent d’être
perdues à cause de fractures.
1.3.2 Thérapie par revascularisation
Dans ce contexte, le traitement basé sur des procédures régénératives endodontiques
devient une alternative forte intéressante. Cette modalité de traitement inclut des
procédures basées sur la biologie, dont l’objectif est de remplacer les structures
endommagées telles que la dentine, les structures radiculaires et les cellules du complexe
pulpo-dentinaire.(33)
12Vous pouvez aussi lire